FDA解除沙瑞普塔公司新一代反义RNA疗法的临床暂停
- 2022-09-08 00:00
- 来源:医药资讯网
- 阅读:212
来源:医学魔方2022-09-08 16336032
今年6月,FDA停止了该诊所,因为一名B期患者出现了严重的低镁血症不良事件。
最近,FDA解除了用于杜氏肌营养不良症的SRP-5051 (Vesleteplersen)的II期临床暂停。在与FDA协商后,Sarepta Therapeutics调整了临床试验计划,包括扩大对尿液生物标志物的监测。

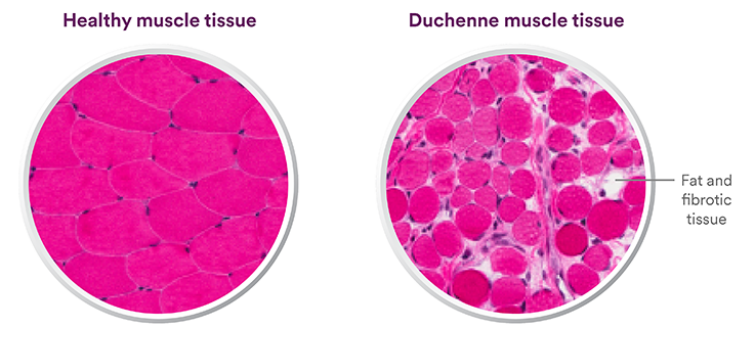
杜兴肌营养不良症(DMD)是一种罕见的疾病,具有致命的遗传性神经肌肉萎缩。它是由编码肌营养不良蛋白的基因突变引起的。最常见的形式是缺失一个或多个外显子(基因的一部分)。正常情况下,dystrophin表达在细胞膜上,与其他蛋白质相互作用,发挥保护作用。而DMD患者很少或不表达这种蛋白,导致肌肉细胞过度损伤和炎症,最终肌肉被疤痕和脂肪组织取代。
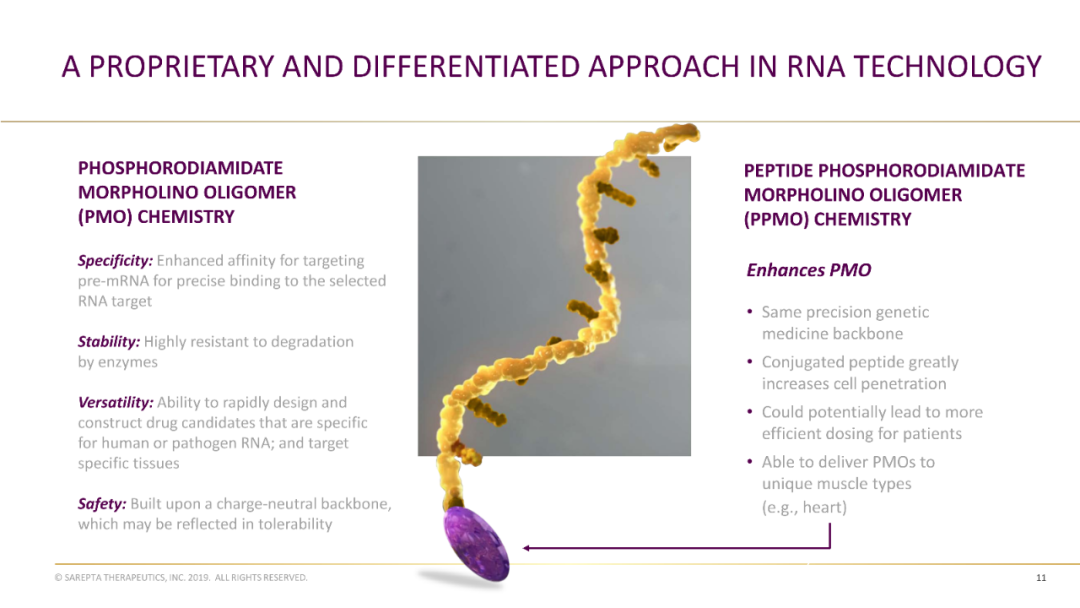
SRP-5051采用公司专有的肽偶联磷酸二酰胺吗啉低聚物(PPMO)化学修饰和外显子跳跃技术。SRP-5051通过与前体mRNA上的外显子51结合,跳过了基因突变片段,实现了蛋白质结构较短但功能正常的dystrophin的产生。
基于PMO(磷酸二甲酯吗啉低聚物)技术开发了沙瑞普他疗法的外显子51。2016年被FDA批准上市,成为全球首个治疗DMD的药物。在PMO骨架的基础上,新一代PPMO连接了一种穿膜肽,可以增强组织渗透。因此,SRP-5051的疗效有望更好,且有减少患者用药次数的潜力。
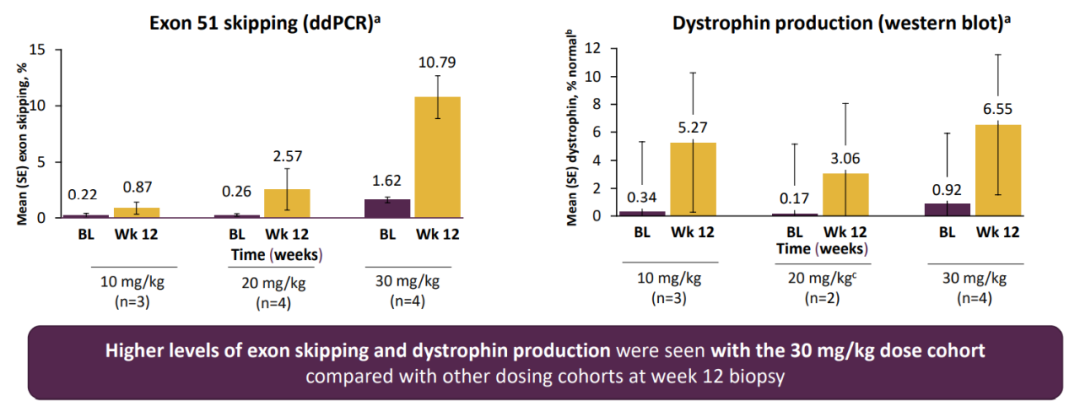
MOMENTUM是一项II期随机、开放标签研究,分为A、B两个阶段,分别为剂量递增和剂量扩大。
2021年,该公司公布了a阶段的结果,与每周一次的外显子51治疗相比,每月一次的SRP-5051(30mg/kg)治疗使外显子51跳跃的频率增加了18倍,dystrophin的产生增加了8倍。
今年6月,FDA停止了该诊所,因为一名B期患者出现了严重的低镁血症不良事件。在接受补充治疗后,患者血清中的镁离子水平恢复正常。在之前的A期试验中,一些患者出现了可逆性低镁血症。
值得一提的是,Sarepta Therapeutics于2019年与罗氏达成合作,共同研发另一款DMD药物SRP-9001,交易总金额为28.5亿美元。
我们感谢FDA的密切合作机会,使临床问题得以迅速解决。我们将尽快实施协议中的变更,以恢复美国的患者管理。Sarepta Therapeutics的执行副总裁兼首席科学官Louise Rodino-Klapac博士说:我们的监测计划旨在避免低镁血症的风险。MOMENTUM将继续招募美国以外的患者,我们仍有望在年底前完成注册。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-

