《自然·癌症》封面论文:吕志民/何杰团队揭示克服免疫抑制因子耐药性的新机制
- 2022-10-26 00:00
- 来源:医药资讯网
- 阅读:121
来源:生物世界2022-10-26 14:09
本研究揭示了肿瘤微环境中补体与免疫细胞之间的内在调节关系,为阻断mCRP功能与PD-1/PD-L1检查点相结合治疗EGFR突变激活的NSCLC的新策略提供了临床前证据,具有较高的临床转化价值。
EGFR突变激活的非小细胞()患者对检查点抑制剂治疗不敏感,是目前肺癌免疫治疗的瓶颈。肿瘤微环境调控和逃逸新机制的发现和详细阐明,给这些NSCLC患者带来了新的希望。
近日,浙江大学转化医学研究所/浙江大学医学院第一附属医院吕志民团队与中国医学科学院肿瘤防治中心/肿瘤医院何杰院士合作,题为:沉默的EGFR上调cd55和cd59的表达激活完成系统和肺癌对检查点阻断的敏感性的研究论文作为封面文章发表在《自然癌症》杂志上。
该研究显示CD55/CD59抗体和PD-1抗体的组合可以克服具有EGFR突变的非小细胞肺癌患者对免疫检查点抑制剂治疗的无应答。

补体系统识别外来病原体和表达异常表面分子的自身细胞,以触发炎症介质的释放、免疫细胞的募集、吞噬作用和细胞溶解。同时,补体系统受到膜结合补体调节蛋白(mCRP,包括CD55和CD59)的紧密负调节和抑制。
吕志民何杰团队发现,NSCLC细胞中EGFR突变的激活增加了肿瘤细胞中CD55和CD59的表达,并抑制了补体激活和CD8 T细胞活性。进一步研究发现,EGFR突变激活使得-catenin与长非编码RNA LINC00973的启动子结合,从而诱导LINC00973的表达。
LINC00973通过吸附miR-216b和miRNA-150上调CD55和CD59的表达,从而抑制补体激活介导的肿瘤微环境中免疫细胞功能,最终实现肿瘤免疫逃逸。研究表明,CD55/CD59抗体与PD-1抗体联合使用,可有效促进肿瘤内CD8 T细胞和M1巨噬细胞的浸润,从而抑制肿瘤的生长,显著延长荷瘤小鼠的生存时间。
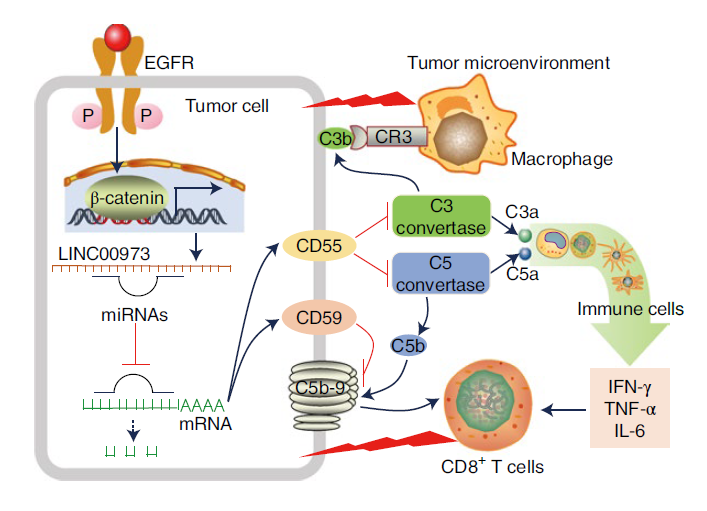
EGFR/-连环蛋白介导的补体抑制、免疫细胞功能抑制和随后的肿瘤生长促进的机制
本研究揭示了肿瘤微环境中补体与免疫细胞之间的内在调节关系,为阻断mCRP功能与PD-1/PD-L1检查点相结合治疗EGFR突变激活的NSCLC的新策略提供了临床前证据,具有较高的临床转化价值。
该研究是继揭示肿瘤细胞AKT/-catenin通路调节免疫检查点PD-L1的机制(实验医学杂志,2020年8月)和揭示肿瘤细胞促进肿瘤免疫逃逸的Warburg效应(细胞代谢,2022年8月)之后,吕志民团队在肿瘤代谢免疫研究方向的又一重要成果。
版权声明
本网站所有标注“来源:100医学网”或“来源:bioon”的文字、图片及音视频资料,版权归100医学网网站所有。未经授权,任何媒体、网站、个人不得转载,否则将追究法律责任。获得书面授权转载时,必须注明“来源:100医学网”。其他来源的文章均为转载文章。本网站所有转载文章都是为了传递更多信息。转载内容不代表本站立场。不想被转载的媒体或个人可以联系我们,我们会立即删除。
87%的用户都在使用100医疗网APP随时阅读、评论、分享、交流。请扫描二维码下载-

