自然子刊:研究揭示B类GPCRs的G蛋白选择性偶联的激活机制
- 2022-11-10 00:00
- 来源:医药资讯网
- 阅读:332
中国科学院上海药物研究所徐华强/赵丽华团队,山东大学萧玉/孙金鹏团队,浙江大学基础医学院张岩团队等。at 《自然-通讯》 (Nature Communications)在线发表了structure insights对一种b类g蛋白偶联受体选择性偶联g蛋白亚型的研究结果。在揭示B类GPCRs一个亚家族中两个受体的激素识别、受体激活和G蛋白偶联的具体机制的基础上,研究人员分别分析了CRF2R与Go蛋白和G11蛋白的复合物的三维结构,即B类GPCRs偶联Go和G11的第一个复合物结构,系统阐述了促肾上腺皮质激素释放因子受体偶联Gs、G11和Go蛋白的分子作用机制,为B类GPCRs的G蛋白选择性偶联激活机制奠定了研究基础。
GPCR是最大的细胞表面受体家族,有800多个成员,调节人体的各种生命活动,与疾病密切相关。超过30%的药物作用于GPCR,因此GPCR被认为是最重要的药物靶点之一。其中,B类GPCR是一类多肽激素受体,包括促肾上腺皮质激素释放因子(CRF)、胰高血糖素(GCG)、胰高血糖素样肽(GLP)、甲状旁腺激素(PTH)等15种激素受体。B-GPCR样受体的信号激活过程主要通过与激动剂结合和与下游G蛋白偶联介导Gs信号通路,也可能介导G i/o、G q/11等信号通路,发挥着从机体生长发育到代谢调节和骨骼发育的广泛生理过程。g样蛋白偶联受体(GPCRs)家族在激素平衡中起着关键作用,是人类重大疾病的重要药物靶点,如癌症、抑郁症、心脏病等。因此,探索G蛋白选择性偶联的激活机制是B类GPCRs研究领域的重要科学问题。
促肾上腺皮质激素释放因子受体(CRF1R和CRF2R)是B类GPCRs的重要成员。两个不同的亚类在中枢和外周神经系统中发挥重要作用,并且是焦虑、抑郁和心血管疾病的重要药物靶标。2020年,徐华强/赵丽华/张岩团队分别发表了CRF1R和CRF2R两个亚型与内源性配体UCN1激活的Gs蛋白三聚体的复合物的高分辨率三维结构。揭示了不同受体配体识别的具体机制,为针对应激反应、焦虑、抑郁和心脑血管疾病的药物研发提供了强有力的结构基础。2017年,萧玉/龚瑶琴/孙金鹏团队在《临床研究杂志》上提出,胰岛细胞分泌的UCN3通过激活胰岛细胞上的CRF2R,构成胰岛内源性细胞回路的UCN3-CRF2R信号轴,通过调节CUL4B/PRC2表观遗传复合物,维持胰岛功能稳态。胰岛内源性UCN3-CRF2R通路的异常阻断导致糖尿病,但UCN3-CRF2R下游与G蛋白亚型偶联的机制和功能仍不清楚。
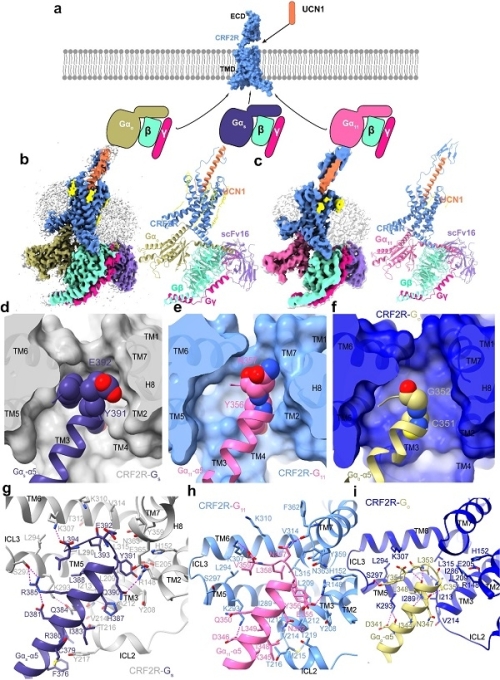
在此基础上,研究团队分析了分辨率分别为2.8和3.7埃的UCN1-CRF2R-Go和UCN1-CRF2R-G11复合物的结构(图1a-c),比较了CRF2R中不同G蛋白(Gs、Go和G11)结合界面的面积和G的5螺旋C端氨基酸侧链的大小。发现Gs蛋白(C端氨基酸)具有最大的侧链、与受体最大的结合面积和最大的相互作用(G11蛋白随后是Go蛋白),这与B GPCRs偶联不同G蛋白的能力一致(Gs Gq/11 Gi/o)。上述研究揭示了G的5-螺旋的C-末端在CRF2R与不同G蛋白的选择性偶联中起决定性作用(图1d-i)。目前所有分析过的B类GPCRs的激活构象与A类GPCRs的不同之处在于,它们在TM6中部向外弯曲约90度,从而在细胞质侧形成更大的结合口袋,有利于G蛋白的结合。这个更大的结合口袋可以与C端氨基酸侧链最大的Gs蛋白形成广泛的相互作用,更好地解释了B类GPCRs经典信号通路中Gs蛋白偶联的分子基础,促进了B类GPCRs在G11,G11中的应用。
CRF2R与不同G蛋白偶联的冷冻电镜结构及选择性偶联G蛋白的分子机制
