Cell Death Differ.:科学家们揭示了TFAP4在淋巴肿瘤发生中的机制
- 2023-04-26 00:00
- 来源:医药资讯网
- 阅读:419
来源:100医药网原创 2023-04-26 09:32
癌基因c-MYC在约70%的人类癌症中异常高表达,如伯基特淋巴瘤(BL)。癌基因c-MYC在约70%的人类癌症中异常高表达,如伯基特(BL)。由于BL和其他淋巴系统恶性肿瘤的发展需要额外的遗传或表观遗传学畸变,这些畸变与失调的c-MYC表达协同作用,研究者之前在体内进行无偏见的全基因组功能性遗传筛选,确定转录因子TFAP4(也称为AP-4)是最热门的基因之一。
TFAP4是一种碱性螺旋-环-螺旋-亮氨酸拉链转录因子,Tfap4的表达本身受到c-MYC的直接调控。TFAP4通过与c-MYC的功能相互作用,包括与相同的基因启动子元件的结合,有助于几种c-MYC调节的细胞过程。
值得注意的是,TFAP4通过结合和调节相同的基因启动子,在感染性攻击后维持生发中心B细胞中c-MYC驱动的增殖和成熟信号至关重要。因此,TFAP4是一种重要的转录因子,作用于c-MYC的下游和/或与c-MYC平行,调节成熟B淋巴细胞的增殖和Ig类转换。

图片来源:
近日,来自沃尔特和伊丽莎.霍尔医学研究所的研究者们在Cell Death Differ.杂志上发表了题为 Deletion of the transcriptional regulator TFAP4 accelerates c-MYC-driven lymphomagenesis 的文章,该研究发现TFAP4的缺失导致B细胞早期发育过程中分化受阻,从而加速c-MYC驱动的淋巴瘤发展。
许多淋巴系统恶性肿瘤是由c-MYC表达失调与其他遗传病变共同作用引起的。虽然已经发现了许多这种协同遗传病变,并对其功能进行了表征,但主要患者样本的DNA序列数据表明,还存在更多的协同遗传病变。
然而,他们对c-MYC驱动的淋巴瘤的贡献的性质尚未得到研究。在先前的全基因组CRISPR敲除体内原代细胞筛选中,研究者确定TFAP4是c-MYC驱动的淋巴瘤发展的有效抑制剂。E -MYC转基因造血和祖细胞(HSPCs)中TFAP4的CRISPR缺失,以及将这些操纵的HSPCs移植到致命辐照的动物中,显著加速了cMYC驱动的淋巴瘤的发展。
有趣的是,TFAP4缺陷型E -MYC淋巴瘤都发生在B细胞发育的前B细胞阶段。这一观察结果促使研究者对移植有E -MYC/Cas9 HSPCs的前期小鼠的前B细胞的转录谱进行表征,这些HSPCs已用靶向TFAP4的sgRNA转导。该分析显示,TFAP4缺失降低了B细胞分化的几种主要调节因子的表达,如Spi1、SpiB和Pax5,它们是TFAP4和MYC的直接靶基因。
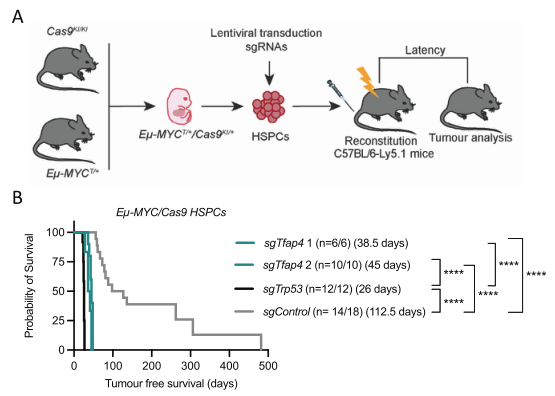
Tfap4的缺失加速了c-MYC驱动的淋巴结肿瘤
图片来源:
综上所述,在c-MYC驱动的血癌中恢复TFAP4的表达,可能不是通过杀死肿瘤细胞,而是通过诱导自我更新的前B淋巴瘤细胞库正常分化为增殖性较低的未成熟/成熟B细胞来改善疾病进展,尽管前提是这些细胞依赖于TFAP4持续缺失来维持淋巴瘤,而不仅仅是淋巴瘤的发展。( 100yiyao.com)
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
