研究人员开发基于gRNA细胞内甲基化的可调控CRISPR
- 2023-06-15 00:00
- 来源:医药资讯网
- 阅读:424
来源:网络 2023-06-14 18:28
CRISPR-Cas系统作为细菌和古菌抵御外源病毒入侵的适应性免疫系统,因其核酸酶和可编程靶向的特点被开发成基因编辑工具并广泛应用。然而,天然的CRISPR-Cas9、CRISPR-Cas12a等基因CRISPR-Cas系统作为细菌和古菌抵御外源病毒入侵的适应性系统,因其核酸酶和可编程靶向的特点被开发成基因编辑工具并广泛应用。然而,天然的CRISPR-Cas9、CRISPR-Cas12a等基因编辑工具存在着体内无法在 时间 和 空间 上被精确控制应用的限制,因此研究者们为了解决这一问题,开发了一系列外源性、可诱导型的CRISPR-Cas基因编辑工具,例如通过蓝光和小分子药物对体内的CRISPR-Cas系统进行 开(on)和关(off) 。但是,这些调控机制都是通过引入外源信号对内源性CRISPR系统进行调控,存在着诱导性差、精确度低等缺点,因此如何开发细胞内源信号调控的CRISPR-Cas系统十分重要。RNA甲基化作为细胞内表观遗传调控的主要途径之一,是细胞增殖以及调控胞内蛋白-RNA相互作用的主要手段。而N6-腺苷酸甲基化(m6A)和N1-腺苷酸甲基化(m1A)作为RNA甲基化修饰中可被去甲基化的两种修饰为我们通过体内调控gRNA从而实现针对整个CRISPR-Cas系统的调控带来了希望。
清华大学化学系张新荣课题组、张四纯课题组与清华大学生命科学学院刘俊杰课题组合作在《化学科学》(Chemical Science)杂志发表了题目为 基于引导RNA甲基化与去甲基化调控CRISPR-Cas12a系统。(Regulation of the CRISPR-Cas12a system by methylation and demethylation of guide RNA) 的研究论文。该研究首次发现针对CRISPR-Cas12a系统gRNA 的5 端核苷酸进行m6A和m1A修饰可以显著的降低该系统的体外顺式(cis-)和反式(trans-)切割活性,并通过EMSA实验进一步验证经过修饰的gRNA与Cas12a蛋白的结合能力减弱,最终导致其切割活性降低。随后,作者通过体外加入去甲基化酶和体内过表达去甲基化酶分别成功实现甲基化修饰gRNA相关的CRISPR-Cas12a系统切割活性的重激活,证明该设计的可行性。最终,作者设计出基于甲基化修饰的诱导型CRISPR-dCas12a基因转录调控策略(demethylase-inducible CRISPR activation strategy,DICa),并成功实现了细胞内由去甲基化酶严格诱导控制的CRISPR基因表达激活。该研究为体内严格控制CRISPR-Cas系统提供了新的思路,进一步提高了基因编辑疗法的安全性和可控性。
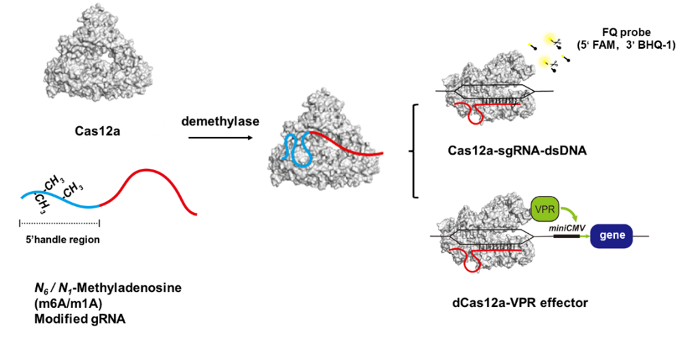
图1. 基于甲基化修饰的诱导型CRISPR-Cas12a系统设计示意图
清华大学化学系张新荣教授、张四纯教授与生命学院刘俊杰助理教授为本文的共同通讯作者。清华大学化学系已毕业博士生胡志安,清华大学生命学院博士生孙奥为本文共同第一作者,共同承担设计和进行实验。其他化学系同学协助课题的完成。
版权声明 本网站所有注明“来源:100医药网”或“来源:bioon”的文字、图片和音视频资料,版权均属于100医药网网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:100医药网”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。 87%用户都在用100医药网APP 随时阅读、评论、分享交流 请扫描二维码下载->
