渐冻症患者诱导多能干细胞建立了新的神经肌肉类器官疾病模型
- 2024-05-23 00:00
- 来源:医药资讯网
- 阅读:269
来源:网络 2024-05-23 12:00
研究人员相信该模型能够用于未来ALS或者其他神经肌肉接头类疾病的药物测试及相关分子机制的研究。西湖大学雷凯团队在Cell Reports在线发表了题为 Neuromuscular organoids model spinal neuromuscular pathologies in C9orf72 amyotrophic lateral sclerosis 的研究成果。
该研究报道了一种利用患者诱导多能(induced pluripotent stem cells, iPSCs)构建神经肌肉类器官(Neuromuscular Organoids, NMOs)的方法,用于研究渐冻症(amyotrophic lateral sclerosis, ALS)的体外疾病模型。研究团队使用C9orf72突变的ALS患者的iPSCs,成功地诱导出NMOs。这些NMOs模拟了包括骨骼肌收缩障碍,神经肌肉接头退化和蛋白异常堆积等疾病相关的病理特征。同时,研究团队还展示了这种类器官模型对测试ALS治疗药物的功效。

文章截图
渐冻症即肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS),是一种多因素共同作用的神经退行性疾病,其主要特征是运动神经元的退行性改变。一般情况下,ALS患者的生存年限不超过两年,仅有10%的患者存活超过5年。目前已确定与ALS发病直接相关的基因有30多种,而家族性患者仅占总病例数的约10%。这些因素限制了小鼠等动物模型的开发,从而限制了ALS的机制研究与药物研发。因此,开发新的能模拟疾病表型且满足高通量筛选的体外疾病模型,对于ALS及其他神经退行性疾病的治疗手段的开发将起到巨大作用。
研究人员利用C9orf72(C9-ALS)患者iPSCs作为模型(C9n1,C9n6,C9n3),经CRISPR/Cas9介导的突变修正iPSCs作为对照(C9n1ISO,C9n6ISO),通过定向诱导手段,构建了神经肌肉类器官(NMOs),用于研究ALS。研究人员发现,NMOs具有与渐冻症神经肌肉退行性病理改变相对应的细胞与组织结构,包括运动神经元、中间神经元、神经胶质细胞、骨骼肌和神经肌肉接头等。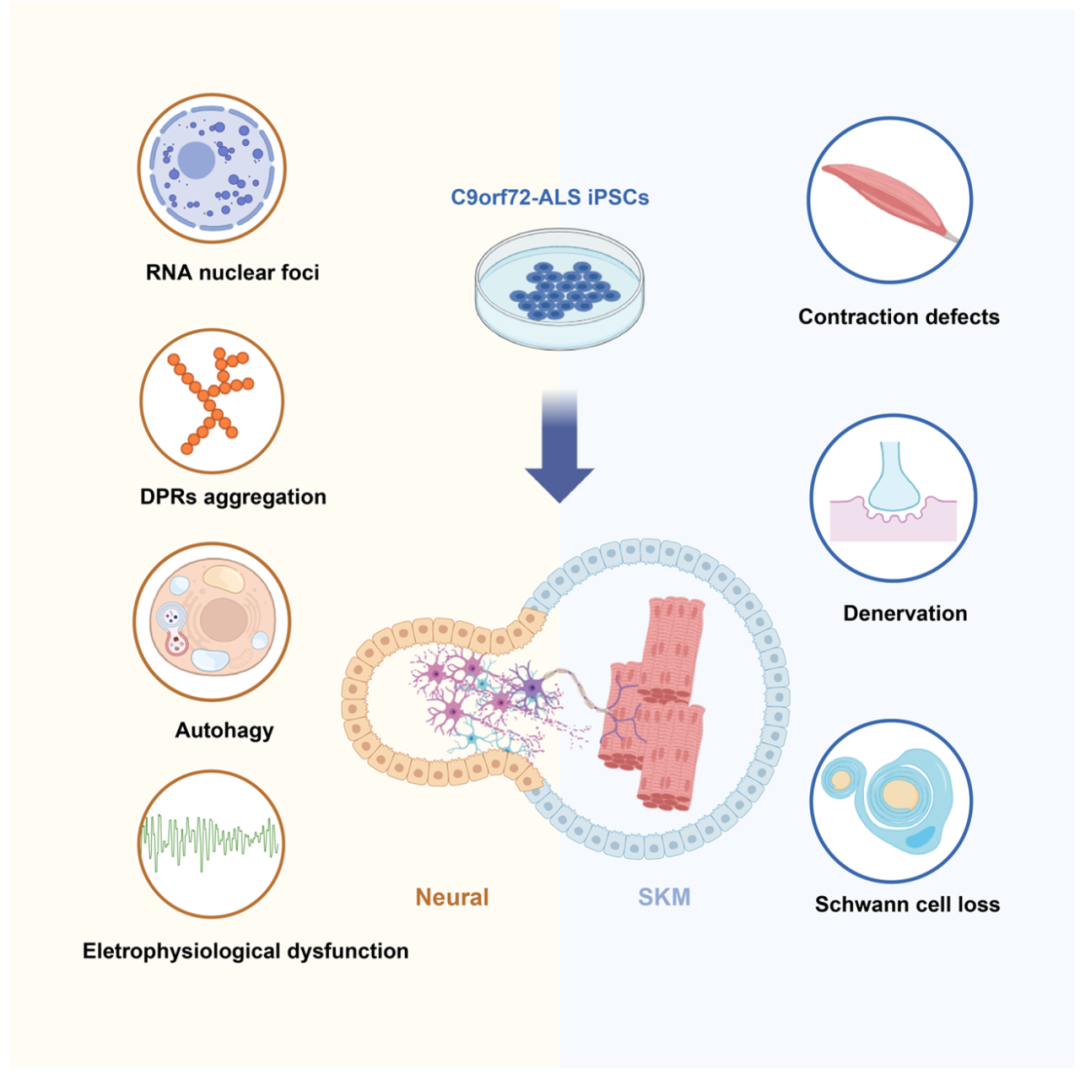 图1. C9orf72-iPSCs构建形成神经肌肉类器官
图1. C9orf72-iPSCs构建形成神经肌肉类器官
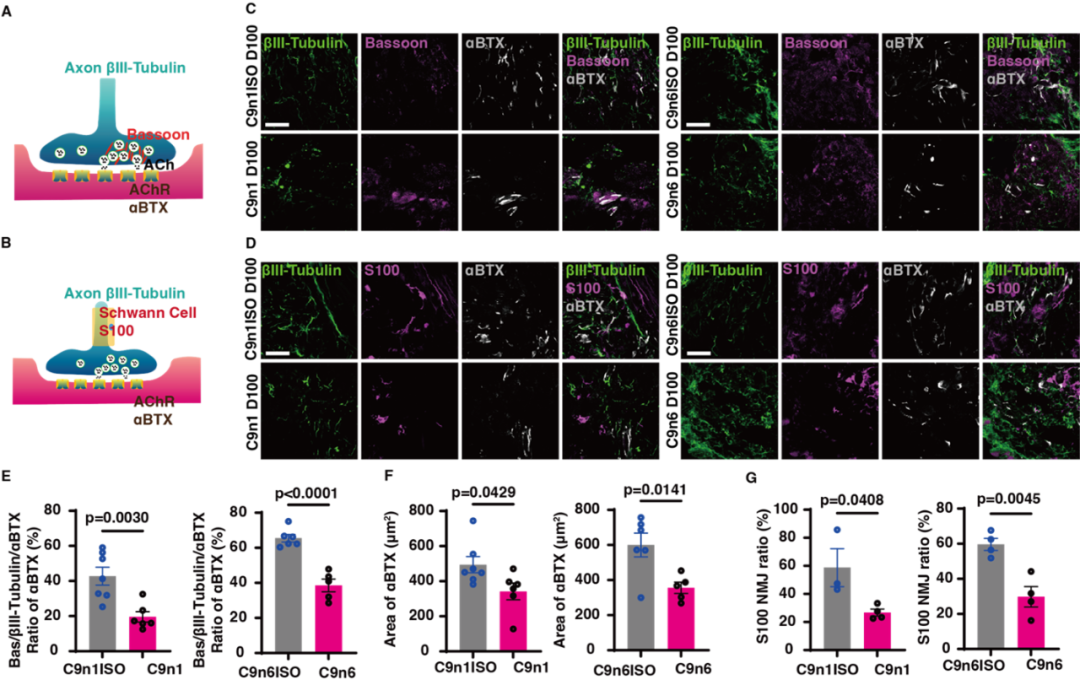

图2. C9orf72-NMOs对ALS相关的骨骼肌失神经的模拟
C9orf72基因突变是其外显子1中插入了高度重复 (GGGGCC)n序列,该重复序列的异常转录及翻译导致细胞核中形成RNA foci,细胞质中形成二肽重复序列蛋白(DPRs)异常聚集。研究人员发现C9-NMOs神经元和胶质细胞中存在RNA foci在细胞核的聚集,以及C9orf72相关的DPRs蛋白PolyGA在细胞质的异常聚集(图3)。这些发现证实,患者来源的NMOs能够模拟C9orf72突变型ALS患者神经组织中的特定病理指征。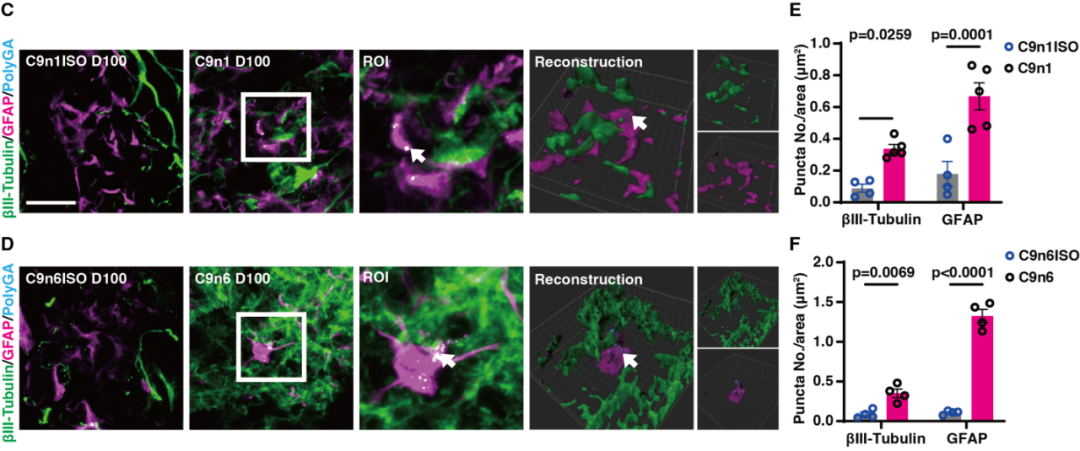 图3. C9orf72-NMOs对其特异性病理指征的模拟效应
图3. C9orf72-NMOs对其特异性病理指征的模拟效应
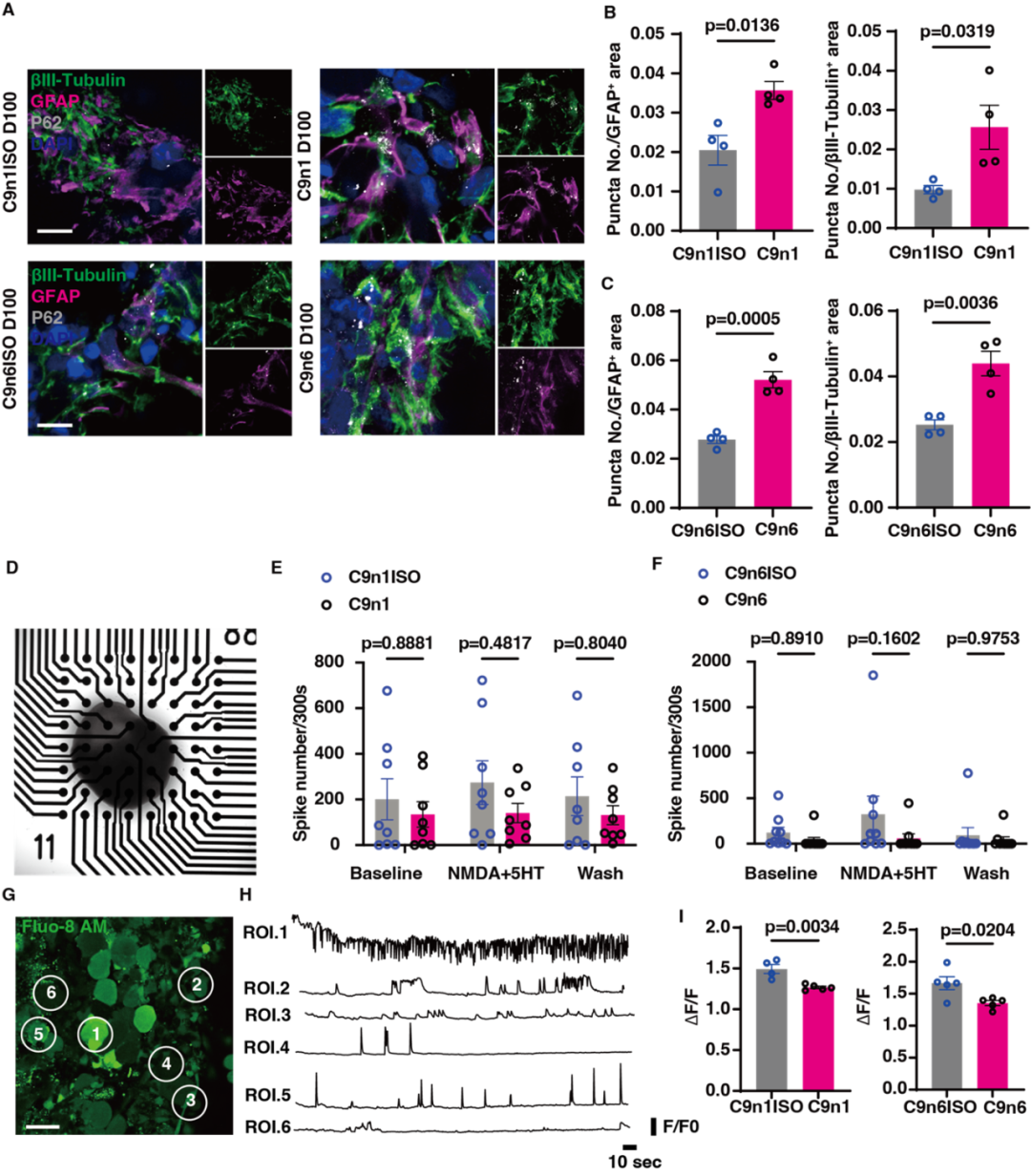
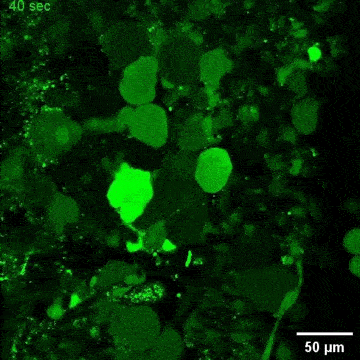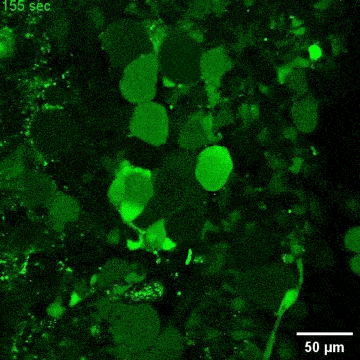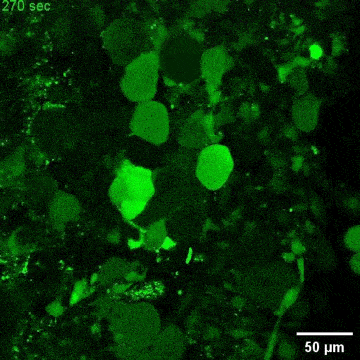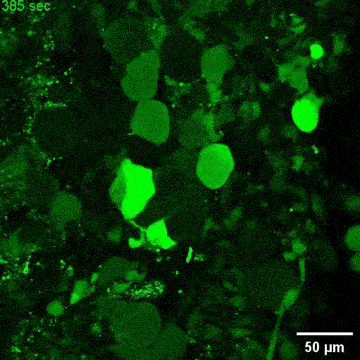 图4. C9orf72-NMOs对ALS相关的神经退行性改变的模拟效应
图4. C9orf72-NMOs对ALS相关的神经退行性改变的模拟效应
