Immunity
- 2024-08-13 00:00
- 来源:医药资讯网
- 阅读:414

为确认外周内皮细胞是否与骨髓内皮细胞执行相同的功能【1, 2】,他们生成了内皮细胞csf1条件性敲除的小鼠(Tie2 Csf1),与对照相比,该小鼠经典单核细胞(CM)没有改变,但NCM急剧减少,这种减少可能由于csf1缺乏直接影响NCM生存,也可能由于NCM分化为组织驻留巨噬细胞。通过对小鼠多个组织器官巨噬细胞的分析,排除了后一可能性,有趣的是,皮下注射重组CSF1-Fc 融合蛋白则能诱导Tie2 Csf1小鼠循环NCM增加60倍。之前的工作表明CX3CR1信号传导可促进单核细胞的体外粘附和存活,CX3CR1缺陷小鼠表现出NCM水平下降,为确定CX3CR1来源,他们再次生成了内皮细胞Cx3cl1条件性敲除小鼠,观察到血液、脾脏和肺中的中间单核细胞和 NCM 均显着减少,足以对Cx3cr1缺陷小鼠进行表型复制。
由于CX3CL1 的趋化粘附特性,该团队推测CX3CL1可能赋予NCM更强的摄取生长因子CSF1的能力。CSF1R(表达与单核细胞表面)与CSF1结合可诱导激活受体的快速内化和溶酶体降解,与对照小鼠相比,从Tie2 Csf1小鼠血液中分离出的循环NCM上的表面CSF1R富集,说明可用CSF1R的表面表达来推断NCM摄取CSF1的量。
基于此,该团队对Cx3cr1正常或缺乏受体小鼠进行辐照后移植tdT+ Cx3cr1骨髓,一个月后检测循环NCM表达CSF1R表达及其Csf1r mRNA表达水平。在WT= WT嵌合体中受体和供体来源NCM的CSF1R和Csf1r mRNA转录本表达相似,相反,在WT= KO嵌合体中,CSF1R mRNA转录物水平相似,但供体NCM表面的CSF1R蛋白少于受体(Cx3cr1缺乏),这些结果提示NCM与内皮的粘附促进内皮CSF1的摄取,并最终促进它们的存活。
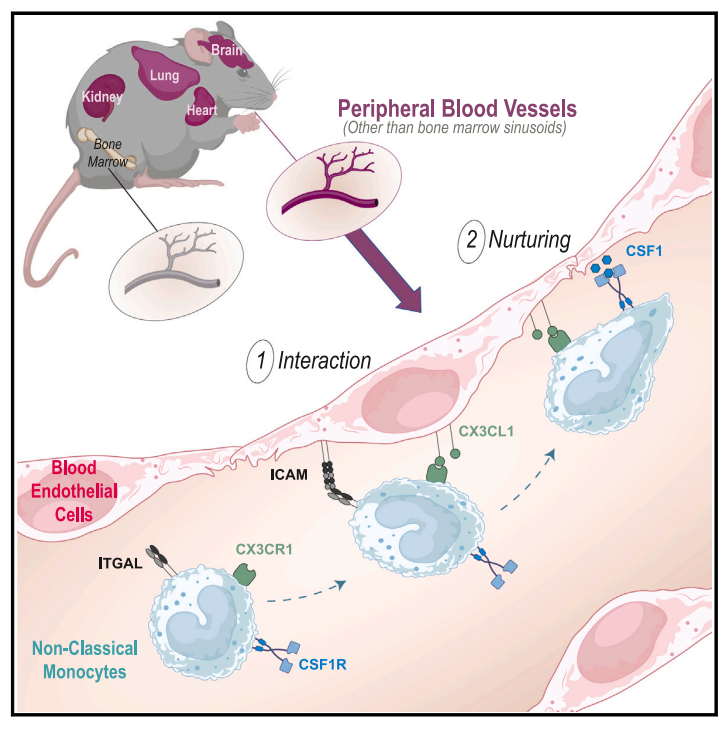
模式图(Credit:Immunity)
综上,这项工作进一步补充了调节NCM稳态的机制,整个 血管树 而非仅仅是骨髓内皮细胞都可充当NCM的生态位。
