Cell Metab
- 2024-08-23 00:00
- 来源:医药资讯网
- 阅读:64

在这项研究中,团队利用慢性束缚压力应激(CRS)小鼠模型,首先发现了14天(每天1小时)的平板跑步机训练可缓解动物的焦虑样行为,并伴随外周-中枢中乳酸累积水平的升高。而利用DCA抑制乳酸生成,可逆转运动的抗焦虑效果。
而利用对前额叶皮质蛋白样本进行了基于乳酰化修饰的蛋白组学定量分析,发现14天平板跑步机运动干预可显著改变多个突触相关蛋白的乳酰化水平。结合定制化抗体,进一步确认了突触蛋白SNAP91在885位点的赖氨酸乳酰化水平在运动后显著提升
随后,通过对SNAP91蛋白885位点进行定点突变(K885R)以抑制其乳酰化活性,并将这一突变蛋白表达在小鼠内侧前额叶皮质(mPFC)区域。透射电镜扫描显示,突触蛋白突变导致了突触前囊泡密度异常下降,并伴随突触结构蛋白表达下调和突触后致密部(PSD)形成异常。
而将这一突变模型应用于CRS+平板跑步机运动干预模型,并结合在体双光子成像,课题组发现mPFC神经网络活动性在表达突变蛋白小鼠中显著下调,并伴随运动抗焦虑效果的抑制,说明运动通过影响SNAP91蛋白乳酰化,维持皮层神经元活动,发挥抗焦虑作用。
综上,这项研究揭示了一条关键性 代谢-脑 通路,其中运动刺激组织产生的乳酸分子可通过影响SNAP91等突触蛋白的乳酰化修饰,改善mPFC突触结构和神经元活动性,缓解小鼠焦虑样行为(下图)。上述结果揭示乳酸这一能量分子在脑内的一条新的生物学机制,也为进一步研究神经组织中非组蛋白乳酰化修饰提供了参考。
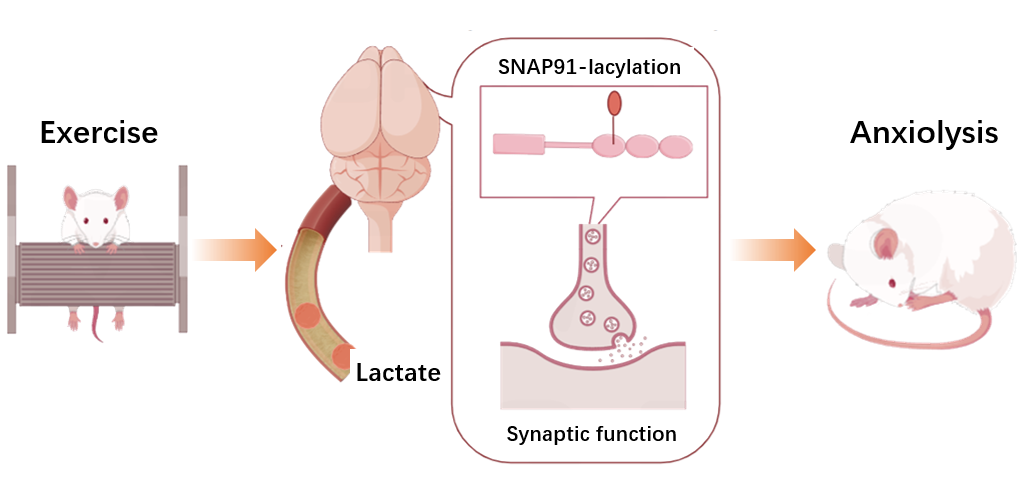 图: 运动-乳酰化抗焦虑模式图(Credit:Cell Metabolism)
图: 运动-乳酰化抗焦虑模式图(Credit:Cell Metabolism)
