Cell Metab:张静等揭示内皮细胞在维持骨骼肌胰岛素敏感性中的关键作用
- 2024-09-14 00:00
- 来源:医药资讯网
- 阅读:45

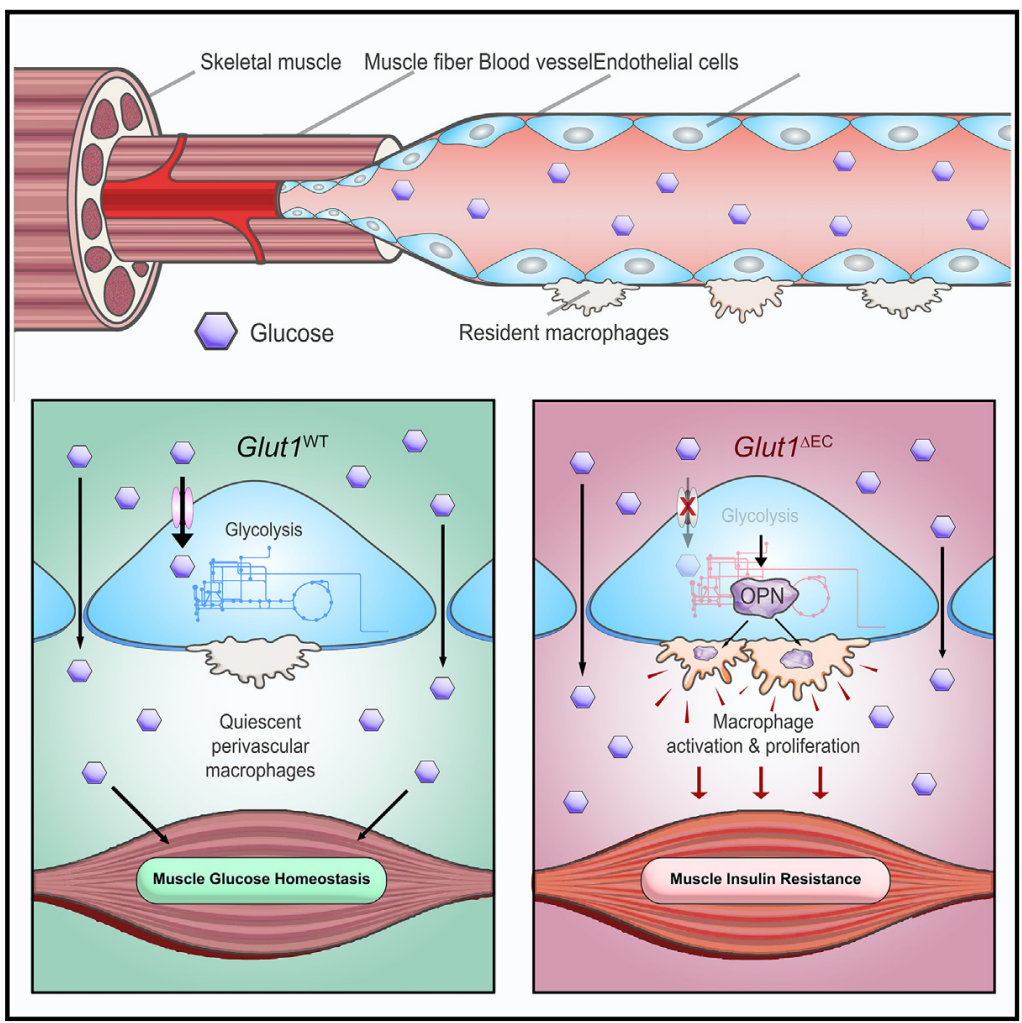
研究人员发现,内皮细胞GLUT1在稳态条件下调控骨骼肌和棕色脂肪组织的葡萄糖吸收,但不参与葡萄糖跨血管的运输。相反,它通过诱导骨骼肌胰岛素抵抗,降低组织对葡萄糖的吸收。骨骼肌的慢性炎症是胰岛素抵抗的主要原因。通过单细胞测序和流式分析,研究人员发现EC特异性GLUT1缺失在短时间内导致骨骼肌驻留巨噬细胞的堆积。骨骼肌中的巨噬细胞有两种来源:骨髓来源和胚胎来源。研究表明,骨髓来源的巨噬细胞是和肥胖患者胰岛素抵抗的主要原因。然而,关于胚胎来源巨噬细胞在代谢稳态中的作用的研究较少。
研究人员发现,EC特异性GLUT1缺失主要导致胚胎来源巨噬细胞的增殖和堆积,而对骨髓来源巨噬细胞的影响较小。为了验证炎症性胚胎来源巨噬细胞堆积是否导致胰岛素抵抗,研究人员分别删除了EC特异性GLUT1缺失小鼠中的这两类巨噬细胞。结果表明,只有通过anti-CSF1R单抗删除胚胎来源的巨噬细胞才能缓解胰岛素抵抗。
为进一步研究内皮细胞是否通过血管分泌机制影响胚胎来源巨噬细胞的增殖,研究人员分离了GLUT1缺失的内皮细胞,并收集其条件培养基刺激骨髓来源巨噬细胞(BMDMs),发现GLUT1缺失的内皮细胞能促进BMDMs的增殖。进一步分析培养基和骨骼肌组织的分泌因子后发现,EC特异性GLUT1缺失导致骨桥蛋白(OPN)分泌增加。通过构建EC特异性Glut1/Spp1敲除小鼠,发现GLUT1缺失引发的胰岛素抵抗得到缓解。
进一步的研究显示,在短期高脂喂养条件下,大鼠的胰岛素抵抗并非由骨髓来源巨噬细胞堆积引起。通过对小鼠进行5天的高脂饮食喂养,研究人员发现EC中的GLUT1表达下降,同时OPN分泌增加,胚胎来源巨噬细胞的增殖上调。这一过程可能通过OPN受体Itga9介导,而非传统的CD44受体。
早期研究表明,OPN可以来源于多种细胞类型,其中髓系细胞是OPN的主要来源之一,也是慢性炎症的诱因之一。通过髓系特异性和EC特异性OPN缺失小鼠模型,研究人员发现髓系特异性OPN缺失虽会导致OPN下降,但对胚胎来源巨噬细胞无明显影响。而EC特异性OPN缺失不仅会导致OPN下降,还能抑制短期高脂刺激下胚胎来源巨噬细胞的增殖,从而缓解高脂饮食引发的胰岛素抵抗。
最后,通过对EC代谢组的检测,研究人员发现GLUT1缺失会导致内皮细胞的葡萄糖代谢重塑。内皮细胞通过降低其下游糖酵解以维持上游支路,如丝氨酸和核糖核苷酸合成的完整性。研究人员进一步筛选发现,培养基中增加丝氨酸和甘氨酸可以增强EC下游的糖酵解,并减少OPN的分泌。如果阻断丝氨酸参与神经酰胺合成的代谢途径,同样可以降低OPN的分泌,从而缓解GLUT1缺失引起的胰岛素抵抗。
综上所述,该研究表明,内皮细胞通过创造免疫调节性微环境,控制驻留巨噬细胞的功能,在维持骨骼肌性方面起到关键作用。
模式图(Credit:Cell Metabolism)
