Cell子刊:江海飞等开发出基于人巨细胞病毒的溶瘤病毒
- 2024-12-24 00:00
- 来源:医药资讯网
- 阅读:358
来源:生物世界 2024-12-24 13:35
在这项最新研究中,研究团队专注于将人巨细胞病毒(HCMV)重组为溶瘤病毒,并在胶质母细胞瘤(GBM)模型中评估其有效性。梅奥医学中心的Stephen J. Russell、江海飞等人在Cell 子刊Cell Reports Medicine上发表了题为:Oncolytic cytomegaloviruses expressing EGFR-retargeted fusogenic glycoprotein complex and drug-controllable interleukin 12的研究论文。
该研究开发了一种表达EGFR重靶向融合基因糖蛋白复合物和药物可控IL-12的溶瘤人巨细胞病毒,并在胶质母细胞瘤(GBM)模型中验证了其显著的抗肿瘤效果。

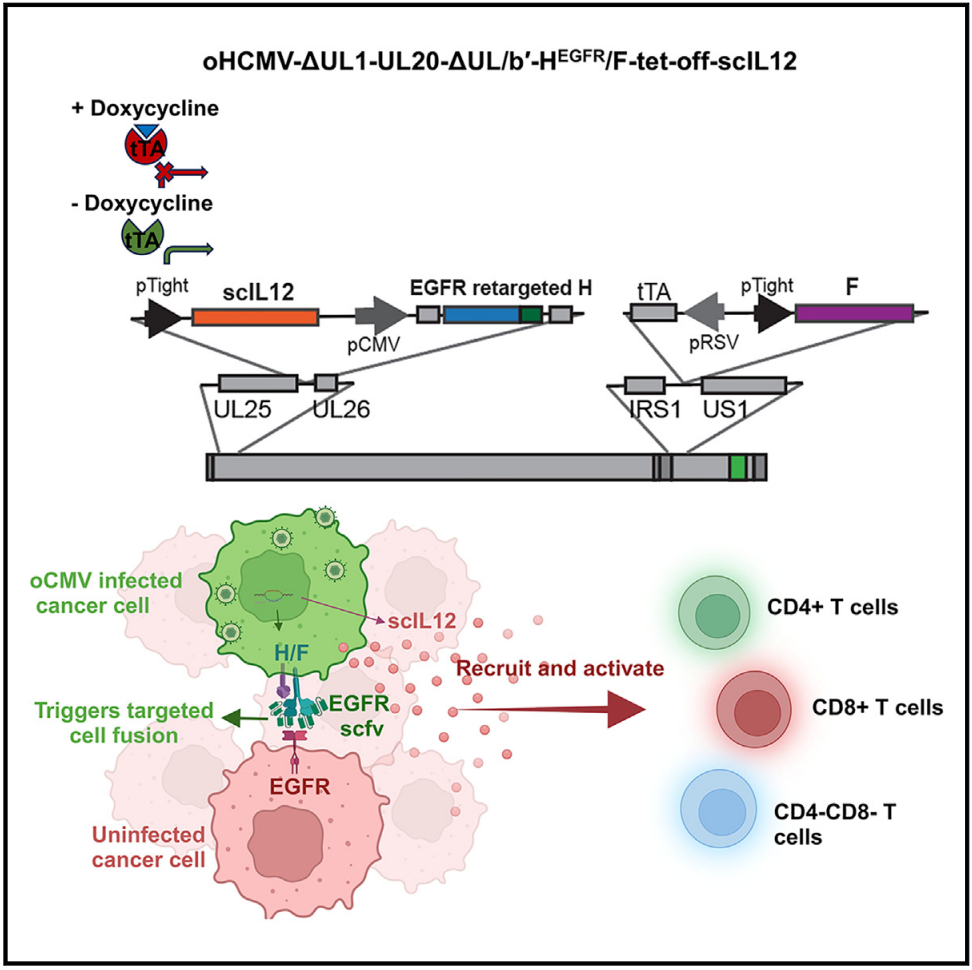
人巨细胞病毒(HCMV)是 -病毒家族的一员,具有约235kb的双链DNA基因组,编码200多个开放阅读框(ORF)。其广泛的细胞趋向性是由病毒颗粒上的糖蛋白复合物调控,其中,gH/gL/gO三聚体复合物(TC)有助于病毒进入所有易感细胞类型,而gH/gL/pUL128-131五聚体复合物(PC)在感染非成纤维细胞中发挥关键作用。
HCMV具有开发为溶瘤病毒平台的潜力,通过有效靶向和癌症相关髓系细胞,在胶质瘤和髓系的治疗中显示出前景。
然而,野生型HCMV的自然感染中通常导致潜伏状态,不足以破坏或激发强大的应答。为了将HCMV改造为有效的溶瘤病毒平台,需要进行以下修改:
1、删除HCMV的潜伏相关基因,尤其是UL/b 区域的基因;
2、结合肿瘤靶向机制,提高其杀伤肿瘤细胞的能力;
3、导入促炎转基因。
在这项最新研究中,研究团队专注于将人巨细胞病毒(HCMV)重组为溶瘤病毒,并在胶质母细胞瘤(GBM)模型中评估其有效性。
为了降低毒力,研究团队从HCMV基因组中删除了UL1-UL20区域(约15kb)和UL/b 序列(约13kb)。为了增强HCMV对肿瘤的靶向性,研究团队为HCMV装备了EGFR重靶向的融合蛋白复合物,其改造自去靶向的副黏病毒糖蛋白H/F,EGFR在包括GBM在内的多种肿瘤中均有表达或扩增。EGFR重靶向的HEGFR/F糖蛋白复合物显著提高了HCMV介导的GBM细胞的溶瘤效果。此外,研究团队还在HCMV基因组中加入了一个Tet-off控制的IL-12基因表达盒,以促进抗应答。携带有HEGFR/F和Tet-off控制的IL-12的溶瘤HCMV在人胶质母细胞瘤异种移植模型中显示出显著的抗肿瘤疗效。此外,研究团队构建了溶瘤鼠巨细胞病毒(mCMV),并在免疫正常的胶质母细胞瘤小鼠模型中评估了其诱导抗肿瘤免疫应答的能力,显著出增加CD4+T细胞、CD8+T细胞和CD4-CD8-T细胞的丰度和细胞毒性。
这些结果强调了人巨细胞病毒作为溶瘤病毒进行了癌症病毒免疫治疗的潜力。