自然结构分子生物学:阿尔茨海默病发病机制的研究进展
- 2022-04-05 00:00
- 来源:医药资讯网
- 阅读:375
《自然结构分子生物学》在线发表了中国科学院深圳理工大学叶克强团队和武汉大学人民医院张振涛团队的最新成果。发现脑内蓝斑去甲肾上腺素的代谢产物DOPEGAL共价修饰了Tau蛋白的K353位点,促进了Tau蛋白的聚集和病灶的扩散。该研究为探索阿尔茨海默病(AD)的发病机制提供了新的视角。
AD是一种神经退行性疾病,Tau蛋白在脑内的异常积聚是AD的重要病理表现。到目前为止,Tau蛋白异常聚集的分子机制仍不清楚。病理学研究发现蓝斑是脑中Tau蛋白聚集的起始位点之一。Tau蛋白首先在蓝斑形成病理性聚集,并扩散到其他脑区,导致Tau蛋白在脑内广泛聚集和神经损伤,最终导致认知功能障碍。那么,为什么蓝斑中的Tau蛋白更容易聚集呢?
研究团队长期以来一直在探索Tau蛋白在大脑中聚集的分子机制。之前的研究发现蓝斑单胺氧化酶A(MAO-A)将去甲肾上腺素氧化为多巴胶,激活天冬酰胺内肽酶(AEP)的表达,AEP剪切Tau蛋白促进其聚集和传播(Journal of Clinical Investigation,2020)。然后,研究小组发现ApoE3与Tau结合,减少了AEP对Tau的剪切,但AD相关等位基因ApoE4失去了与Tau蛋白结合的能力,使Tau更容易被AEP剪切;ApoE4可以抑制囊泡单胺转运体VMAT的水平,使去甲肾上腺素难以进入突触小泡,而是停留在细胞质中,被MAO-A氧化生成多巴凝胶(Acta Neuropathologica,2021)。
最新的研究进一步探索了多巴凝胶对Tau的修饰,发现多巴凝胶可以直接共价修饰Tau的K353位点。与全长Tau蛋白相比,通过AEP剪切形成的Tau蛋白片段更容易被DOPAGEL修饰。DOPAGEL修饰的Tau蛋白具有更强的聚集能力,作为种子形成的病理聚集体具有更强的诱导Tau蛋白单体的聚集能力。阻断Tau转基因小鼠脑内MAO-A的活性或突变Tau的K353位点,可以阻断多巴凝胶对Tau的修饰,部分缓解Tau病变的扩散。
本研究揭示了为什么在ad发病过程中蓝斑Tau蛋白首先聚集形成病理性包涵体,对于解释AD患者脑内Tau蛋白聚集的启动和扩散有重要启示。这样就可以在AD早期通过小分子药物抑制MAO-A或大大减缓Tau的病变。然而,这一新机制能否推广到其他与tau蛋白病变相关的tau蛋白疾病,还需要进一步的实验验证。
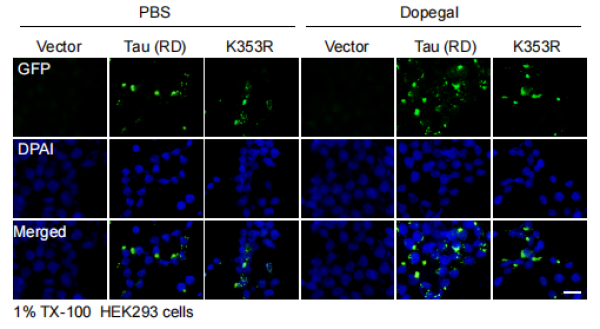
图一。DOPAGEL促进细胞内Tau的聚集,而K353R突变可以阻断DOPEGAL的促进作用。
