人福140万美元西提ANDA产品国内销量飙升
- 2022-04-12 00:00
- 来源:医药资讯网
- 阅读:106
4月9日,人福药业发布公告称,控股子公司宜昌人福药业收到FDA的布洛芬片剂批准文号,这意味着可以在美国市场生产和销售。人福医药在制剂出口海外的赛道上硕果累累。目前,它已经获得了90多个ANDA号码。
表1:人福医药最新获批产品
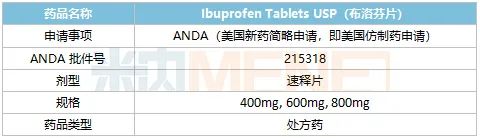
来源:公司公告
布芬片适用于缓解轻至中度疼痛,如头痛、关节痛、偏头痛、牙痛、肌痛、神经痛、痛经和感冒或流感引起的发烧。
据悉,宜昌人福于2021年提交了布洛芬片的ANDA申请,累计研发;d投资约140万美元。公司表示,布洛芬片剂获得FDA批准文号表明宜昌人福有资格在美国市场销售该产品,将对公司拓展美国仿制药市场产生积极影响。公司后续将积极推进该产品在美国市场上市的准备工作。
宜昌人福的布洛芬片在国内市场也有销售。公司2017年开展一致性评价研究,2019年开展生物等效性研究。2019年8月申报,2020年9月获批评估。该产品成功中标第四批国家级产品,随后销量迅速增长。Minenet数据显示,2021年上半年,宜昌人福药业成为中国城市公立医院、县级公立医院、城市社区中心、乡镇卫生院(简称中国公立医疗机构)终端布洛芬片企业格局的TOP4企业,市场份额高达6.05%。
表2:人福医药获得的ANDA数
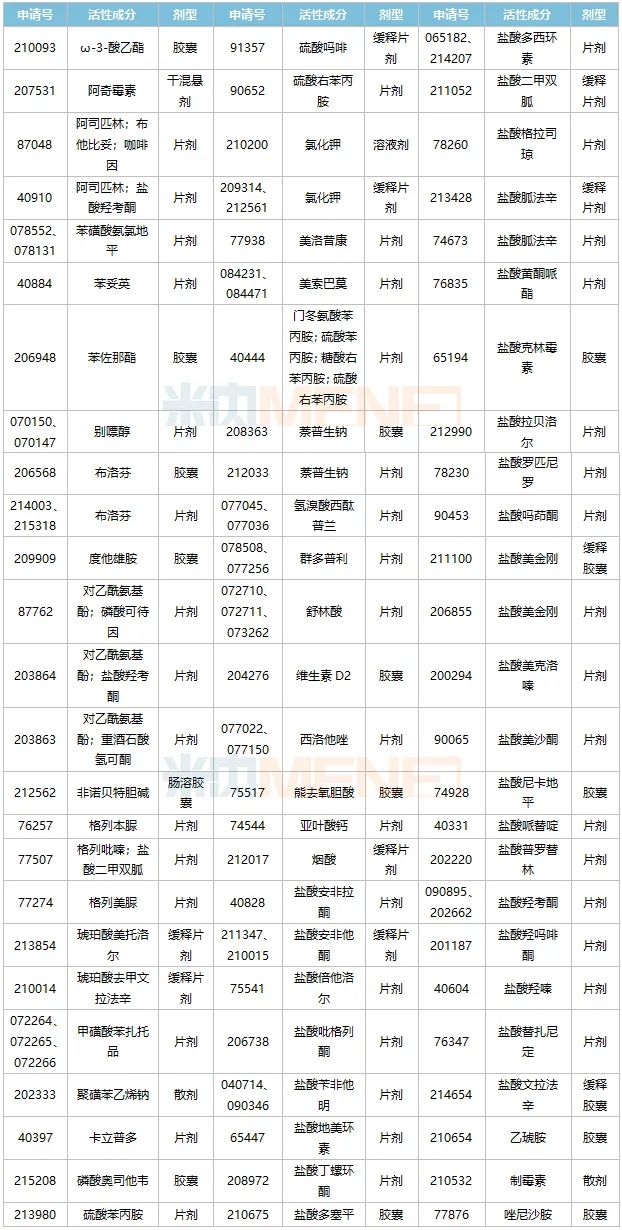
来源:Minenet全球上市药物数据库
资料显示,人福医药已获得90多个ANDA号,涉及75个产品(活性成分剂型)。在制剂出口海外的轨道上,人福医药一直处于领先地位。
来源:公司公告、内部网数据库
注:ANDA数据统计截至4月6日,如有遗漏,请指正!
