原发性肝癌模型的构建和应用进展
- 2022-05-06 00:00
- 来源:医药资讯网
- 阅读:165
原发性肝癌是我国发病率和死亡率较高的恶性肿瘤。其发病的分子机制复杂且不清楚。由于缺乏模拟人类肝癌的研究模型,人类肝癌的分子机制及其治疗的研究进展仍然缓慢。近年来,人源化小鼠肝脏模型已广泛应用于药物验证和癌症等研究中。如果能够在人源化模型中将人原代肝细胞诱导成肝癌,将有助于解决肝癌发生的关键分子机制和临床前药物验证模型。
近日,中国科学院广州生物医药与健康研究院研究员、李在Reports上发表了题为《基因调控因子将人原代肝细胞转化为肝癌》的研究成果。用人原代肝细胞诱导原发性肝癌模型并应用。
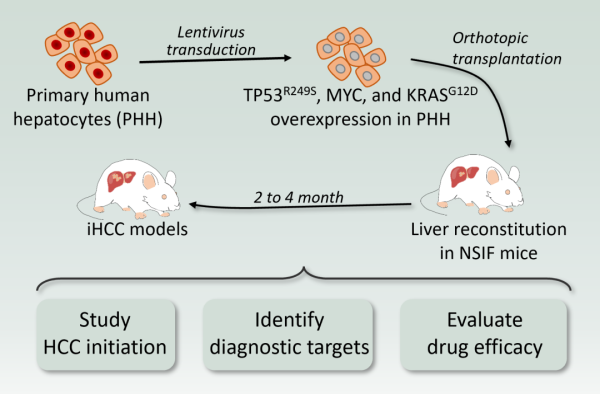
为了筛选能够直接诱导原代肝细胞成为肝癌细胞的癌基因/突变型抑癌基因组合,研究人员采用多基因混合转染的方法转染原代细胞,利用肝脏的人源化小鼠模型进行体内筛选。最后发现诱导的肿瘤高表达MYC、TP53R249S和KRASG12D。荧光结果显示该类肿瘤细胞高表达GPC3、AFP和CK19,不表达EpCAM,证明该模型诱导的肿瘤为肝癌,即诱导性肝癌。进一步的验证表明,MYC和TP53R249S的联合表达可以诱导PHH直接原位转化为肝细胞癌(iHCC),而KRASG12D可以显著增加其成瘤率。生物学分析表明,iHCC与临床HCC样本具有相同的基因表达谱特征,且在连续移植后仍能保持HCC的特征。
结合转录组分析,研究人员发现,MUC1和FAP在肝细胞癌中高表达,而在正常肝脏中不表达。因此,分别制备了针对MUC1和FAP的嵌合抗原受体(CAR) T细胞,体内外杀伤结果表明,这两种细胞能有效杀伤iHCC细胞,为肝癌的临床治疗提供了新的标志物和潜在的治疗靶点。从该模型获得的肿瘤细胞用于在体外和体内评价MEK1/2抑制剂(曲马替尼)和CDK4/6抑制剂(palbociclib,Bosini)对肝癌的治疗效果。结果表明,联合用药能有效诱导肝癌细胞进入衰老状态并最终死亡,为肝癌的临床治疗提供了新的治疗方案。本研究为探索肝癌的发生发展提供了实验和理论基础,诱导肝癌(iHCC)模型可用于探索肝癌早期标志物、筛选新靶点和评价肝癌药物疗效。
相关研究工作得到了国家科技攻关项目的资助。d计划,国家和广东省重点研发。d计划和其他项目。
广州生命科学研究所在原发性肝癌模型的构建和应用方面取得进展。
